Table of Contents
Proteinele șoc termic dezvăluite: Aflați despre rolul vital al acestor chaperoni moleculari în sănătatea celulară, răspunsul la stres și implicațiile lor potențiale pentru diverse afecțiuni medicale.
Principalele concluzii
- Definiție: Proteinele de șoc termic (HSP) sunt proteine de stres care ajută la supraviețuirea celulelor prin protejarea celulelor de stres, cum ar fi căldura și toxinele.
- Funcție: HSP ajută la plierea proteinelor în cadrul reticulului endoplasmatic și sunt cruciale pentru repararea celulară.
- Tipuri: Alte proteine de șoc termic au diverse funcții, inclusiv ajutarea celulelor prezentatoare de antigen în răspunsul imun.
- Beneficii pentru sănătate: HSP-urile sunt legate de longevitate și de protecția împotriva bolilor prin răspunsul transcripțional la șocul termic.
- Activare: Activitățile precum exercițiile fizice și utilizarea saunei stimulează producerea acestor proteine.
- Cercetare: Studiile se concentrează pe rolul lor în tratarea bolilor neurodegenerative și a cancerului.
Ce sunt proteinele șoc termic?
Proteinele de șoc termic (HSP) sunt un grup de proteine prezente în aproape toate organismele vii, de la bacterii la oameni. Acest fapt sugerează că aceste proteine au evoluat de timpuriu și au roluri semnificative în majoritatea ființelor.
Acestea sunt produse ca răspuns la expunerea celulelor la condiții stresante. Aceste condiții stresante au fost înțelese în principal ca fiind șocul termic.
Cu toate acestea, știm că proteinele de șoc termic sunt, de asemenea, produse în timpul expunerii la frig și la lumina UV și atunci când o rană se vindecă sau este prezentă remodelarea țesutului.
Proteinele de șoc termic sunt împărțite în funcție de greutatea moleculară, structură și funcție în cinci familii majore: HSP100, 90, 70, 60 și proteine mici de șoc termic (sHsp). Fiecare număr se referă la greutatea respectivă a proteinei în kilodaltone.
Mica proteină ubiquitină are o dimensiune mică de opt kilodaltone și are caracteristici de proteină de șoc termic, marcând proteinele pentru degradare.
O sHsp are un domeniu alfa-cristalin de aproximativ 80 de aminoacizi. S-a constatat că sHsp acționează ca chaperoni cu greutate moleculară mică, ajută la reglarea asamblării citoscheletului și sunt asociate cu miofibrile.
Cele mai comune proteine de stres pot crește la niveluri ridicate în celulele cu proteine de șoc termic, dar pot exista, de asemenea, la niveluri scăzute sau moderate în celulele care nu au fost expuse la stres, demonstrând că joacă un rol în celulele normale.
La majoritatea mamiferelor, Hsp90 și Hsp60 sunt abundente la temperaturi normale, însă proteina de șoc termic 70 (Hsp70) este abia detectabilă, dar este indusă în continuare de stres.
În Escherichia coli, de exemplu, la temperaturi normale, Hsp6p și Hsp70 reprezintă 1,5% din proteinele totale ale celulei, dar după șocul termic reprezintă 30%. S-a demonstrat că acest tip de HSP sporește expresia moleculelor de adeziune celulară intracelulară și a moleculelor de adeziune celulară vasculară.
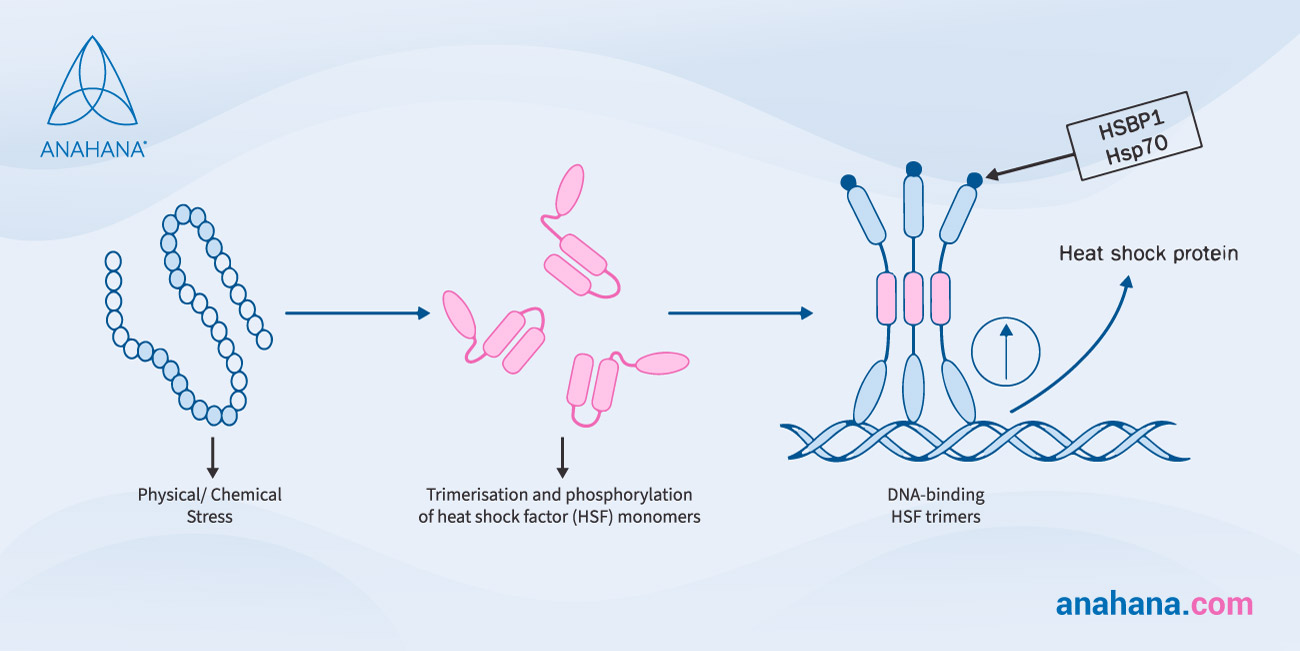
Anumite proteine de șoc termic funcționează ca un chaperon, stabilizând noile proteine pe măsură ce sunt create, asigurându-se că acestea pliază sau repliază corect proteinele deteriorate de stresul termic. Acest proces este reglementat transcripțional, în care un segment de ADN este copiat în ARN.
Proteinele de șoc termic sunt upregulate, un proces prin care celula crește dramatic cantitatea unei componente celulare, cum ar fi ARN sau proteine, după ce a fost supusă unui stimul extern.
Această creștere este esențială pentru răspunsul la șocul termic și este indusă de factorii de transcripție numiți factori de șoc termic (HSF).
Descoperire
Proteinele de șoc termic au fost descoperite accidental în 1962 de către geneticianul italian Ferruccio Ritossa.
Acestea au fost numite proteine de șoc termic datorită sintezei lor crescute după șocul termic la muștele de fructe pe care le-a studiat Ritossa.
El a observat că căldura și decuplajul metabolic 2,4-dinitrofenol au cauzat un model special de "umflare" a cromozomilor la muștele de fructe care au suferit un șoc termic.
Această umflare a exprimat proteine de șoc termic, numite și proteine de stres. În 1974, Alfred Tissieres, Herschel Mitchell și Ursula Tracy au descoperit că șocul termic încurajează producerea unui anumit număr mai mic de proteine și suprimă producerea unui număr mai mare de proteine.
Această descoperire a dat startul unui număr mai mare de studii privind aceste constatări biochimice referitoare la inducerea șocului termic și rolul acestuia.
Funcția proteinelor de șoc termic
Proteinele de șoc termic au câteva roluri diferite. Cinci roluri semnificative sunt importante pentru a înțelege - reglarea în stres, rolul de chaperon, gestionarea proteinelor, sănătatea cardiovasculară și imunitatea.
Upregulare în stres
Producția de cantități mari de proteine de șoc termic, cunoscute și sub denumirea de proteine de stres, este declanșată de stresuri de mediu și metabolice, cum ar fi:
- Infecție
- Inflamația
- Exercițiu
- Lumina UV
- Înfometare
- Lipsa oxigenului sau a apei (hipoxie)
- Deficitul de azot în plante
- Expunerea la materiale nocive precum etanol, arsenic, urme de metale, etanol, nicotină
- Stresul chirurgical și agenții virali
Această creștere a proteinelor de șoc termic în timpul stresului de mediu face parte din răspunsul la stres.
În timpul acestor stresuri de mediu, proteinele membranei externe nu se pot plia și nu se pot potrivi corect în membrana externă și, prin urmare, se acumulează în spațiul periplasmic, unde proteinele membranei externe sunt detectate de o protează a membranei interne, care transmite semnalul prin membrană factorului de transcripție sigmaE.
Factorii Sigma sunt subunități ale ARN polimerazei care dețin roluri critice în inițierea transcripției, care ajută la etapele inițiale ale sintezei ARN.
Cu toate acestea, unii cercetători descoperă că proteinele de șoc termic sunt recrutate atunci când există o creștere a proteinelor deteriorate sau anormale.
Anumite proteine bacteriene de șoc termic suferă acest proces de creștere prin recrutarea unui mecanism care implică termometre ARN. Aceste termometre ARN reglează expresia genelor în timpul răspunsurilor la șocul termic și la șocul la rece.
O descoperire importantă a fost făcută de cercetători care au constatat că atunci când un "pretratament ușor de șoc termic" a fost aplicat la muștele de fructe, acesta a indus expresia genei de șoc termic, afectând în principal traducerea ARN-ului mesager și nu transcrierea ARN-ului.
Acest proces a îmbunătățit semnificativ supraviețuirea lor după un șoc termic la o temperatură mai ridicată.
În sens invers, proteinele de șoc termic au fost sintetizate și la muștele de fructe atunci când au fost expuse la o expunere prelungită la frig, mai degrabă decât la șoc termic.
Acest rezultat este semnificativ, deoarece arată că, atunci când sunt expuse la un pretratament de șoc termic ușor, există beneficii succesive în prevenirea deteriorării și a morții atunci când sunt expuse la un șoc termic ulterior și la expunerea la frig.
Rolul de chaperoni moleculari
Anumite proteine de șoc termic acționează, de asemenea, ca chaperoni moleculari intracelulari pentru alte proteine, jucând un rol central în interacțiunile dintre plierea proteinelor, asigurând conformația adecvată a proteinelor și prevenind agregarea proteinelor.
Proteinele de șoc termic acționează ca stabilizatori în desfășurarea proteinelor greșit pliate și ajută la transportul proteinelor prin membranele celulare.
Deoarece acest rol de chaperon molecular este crucial în menținerea proteinelor, proteinele de șoc termic au fost găsite la niveluri scăzute în aproape toate organismele.
Management
Atunci când proteinele de șoc termic nu sunt expuse la factorii de stres din mediu, acestea acționează ca "monitoare", monitorizând proteinele din celule.
Procesul de monitorizare face parte din sistemul de reparare al celulei, denumit răspuns celular la stres sau răspuns la șoc termic; acesta constă în transportul proteinelor vechi către proteazomul celular și ajutarea proteinelor nou sintetizate să se plieze corect.
Proteinele de șoc termic par mai predispuse la autodegradare în comparație cu alte proteine din cauza acțiunii lor proteolitice, care este descompunerea proteinelor în polipeptide sau aminoacizi în timpul stresului oxidativ, agresiunii proteolitice sau inflamației.
Cardiovascular
Rolul pe care proteinele de șoc termic îl joacă în sistemul cardiovascular este semnificativ, Hsp90, Hsp84, Hsp70, Hsp27, Hsp20 și cristalina ɑB jucând toate un rol important în sistemul cardiovascular.
Aceste roluri includ legarea oxidului nitric sintetazei endoteliale și a guanilatciclazei, care sunt implicate în relaxarea vasculară, gestionarea stresului oxidativ și a factorilor fiziologici și reglarea morfogenezei cardiace. HSP-urile joacă, de asemenea, un rol în:
- Dezvoltarea fenotipului mușchiului neted (tip de mușchi în sistemele respirator, urinar, gastrointestinal și reproducător)
- Prevenirea agregării plachetare
- Funcția miocitelor cardiace
- Prevenirea apoptozei după un prejudiciu ischemic
- Funcția mușchilor scheletici
- Răspunsul mușchilor la insulină
Proteinele de șoc termic pot fi, de asemenea, ținte terapeutice potențiale pentru a întări apărarea vasculară și pentru a întârzia sau evita complicațiile clinice care apar în urma aterotrombozei - o boală cardiovasculară.
Imunitate
Proteinele de șoc termic joacă un rol în imunitate deoarece se leagă de proteine și peptide întregi. Cu toate acestea, această interacțiune este rară, în principal Hsp70, Hsp90 și gp96 și site-urile lor de legare a peptidelor conținând această capacitate.
În plus, proteinele de șoc termic stimulează receptorii imuni și rolul lor în plierea corectă a proteinelor implicate în căile de semnalizare pro-inflamatorii.
Semnificație medicală
Factorul de șoc termic 1 (HSF-1)
HSF-1 este un factor de transcripție care joacă un rol în menținerea și reglarea expresiei Hsp70, pe care cercetătorii au descoperit-o ca fiind un modificator multifațetat al carcinogenezei. Carcinogeneza este procesul prin care celulele normale se transformă în celule canceroase.
Într-un studiu efectuat pe șoareci HSF-1 knockout, în care cercetătorii au aplicat un mutagen topic (un agent chimic care dăunează permanent materialului genetic) de DMBA, șoarecii HSF-1 au prezentat o rată redusă a tumorilor cutanate.
În plus, s-a constatat că inhibarea HSF-1 de către un aptamer ARN atenuează semnalizarea mitogenică și începe apoptoza, programul de moarte celulară a celulelor canceroase.
Diabetul zaharat
Diabetul zaharat este o boală imunitară cu exces de glucoză (hiperglicemie), provocată de obicei de un deficit de insulină. Noi cercetări sugerează o corelație între Hsp70, Hsp60 și diabetul zaharat.
Unele cercetări arată că raportul dintre eHsp70 și iHsp70 ar putea afecta diabetul zaharat, indicând că eHsp70 și iHsp70 sunt biomarkeri pentru starea glicemică și inflamatorie a pacienților.
Mai mult, un studiu a analizat Hsp70 în serul sanguin la pacienții cu diabet comparativ cu pacienții de control (fără diabet) și a constatat că acei pacienți cu diabet aveau niveluri semnificativ mai ridicate de Hsp70 și chiar mai ridicate la pacienții care aveau diabet de mai mult de cinci ani decât cei nou diagnosticați.
Această constatare sugerează că nivelurile de Hsp70 din serul sanguin indică dereglări metabolice în cursul diabetului.
Cancerul
Proteinele de șoc termic au potențialul de a juca un rol crucial în identificarea cancerului. S-a demonstrat că expresia ridicată a proteinelor extracelulare de șoc termic indică celule tumorale foarte agresive.
De asemenea, se corelează cu proliferarea celulară, stadiul cancerului și rezultatele clinice slabe, ceea ce indică utilizarea potențială a expresiei proteinei de șoc termic în procesul de diagnosticare a cancerului. Oncologii au început chiar să utilizeze proteinele de șoc termic pentru diagnosticarea cancerului oral.
Tehnici precum dot imunoassay și ELISA și-au demonstrat potențialul în diagnosticarea cancerului. Cercetătorii au stabilit că anticorpii fagici specifici HSP sunt benefici în diagnosticarea cancerului în eprubetă (in vitro).
De asemenea, s-a demonstrat că proteinele de șoc termic interacționează cu adaptările cancerului, cum ar fi rezistența la medicamente, producția de celule tumorale și durata de viață. Reglarea în sus și în jos a microARN asociat cu cancerul se numește oncomir.
Hsp90 este unul dintre cei mai promițători candidați pentru diagnosticarea, prognosticul și tratamentul cancerului, iar Hsp70, Hsp60 și HSP mici s-au dovedit a avea beneficii potențiale pentru tratament:
- Boala neurodegenerativă
- Ischemie
- Moartea celulară
- Autoimunitate
- Respingerea grefei
- Alte boli grave
Aplicații farmaceutice
Vaccinuri împotriva cancerului
Proteinele de șoc termic acționează eficient ca adjuvanți imunologici, care pot crește răspunsul imun la un vaccin.
În plus, unele studii sugerează că proteinele de șoc termic ar putea fi implicate în legarea fragmentelor proteice ale celulelor moarte și maligne, cum ar fi celulele canceroase, și aducerea lor la sistemul imunitar pentru a le combate.
De asemenea, s-a constatat că proteinele de șoc termic au un impact asupra căilor de semnalizare care fac parte din formarea celulelor canceroase sau a carcinogenezei. În cele din urmă, proteinele de șoc termic pot crește eficiența vaccinurilor împotriva cancerului. Proteinele de șoc termic izolate din celulele tumorale pot acționa ca un vaccin anti-tumoral.
Deoarece celulele tumorale sunt supuse unui stres continuu și trebuie să neutralizeze un număr mare de oncogene mutante sau gene cauzatoare de cancer, acestea creează o cantitate excepțională de proteine de șoc termic în celulele tumorale.
Atunci când sunt izolate din tumoare, aceste proteine de șoc termic au un repertoriu peptidic care acționează ca o hartă sau amprentă a celulelor tumorale din care provin.
Aceste proteine de șoc termic au potențialul de a fi aplicate pacientului pentru a ajuta la lupta împotriva tumorii, cu scopul de a determina regresia tumorii.
Terapeutică anticancerigenă
Proteinele de șoc termic sunt puternic exprimate intracelular în celulele canceroase. Acestea sunt esențiale pentru supraviețuirea celulelor canceroase, promovând chiar și celulele mai invazive sau formarea de metastaze ale tumorilor.
Din acest motiv, inhibitorii moleculare mici ai proteinelor de șoc termic, cum ar fi Hsp90, au potențialul de a fi un tratament anticancerigen. Cercetătorii studiază aceste terapii potențiale. Cu toate acestea, studiile clinice nu au trecut încă.
Tratamentul autoimunității
Proteinele de șoc termic pot acționa ca modele moleculare asociate daunelor, molecule din celule care fac parte din răspunsul imunitar înnăscut eliberat de celulele care mor în urma unei traume sau infecții. Prin urmare, proteinele de șoc termic pot încuraja extracelular anumite boli autoimune.
Cu toate acestea, s-a constatat că proteinele de șoc termic pot fi utilizate la pacienții cu boli autoimune pentru a induce toleranța imună și a ajuta la tratarea acestor boli.
Inhibitorii Hsp90 au, de asemenea, potențialul de a trata bolile autoimune cu rolul lor în plierea corectă a proteinelor pro-inflamatorii. Boli precum artrita reumatoidă și diabetul de tip 1 pot fi tratate prin tratamente autoimunitare.
Aplicații la domiciliu
Expunere la căldură
Expunerea deliberată la căldură, în special utilizarea saunei, poate juca un rol benefic în menținerea sănătății și are beneficii care variază de la sănătatea cardiovasculară la eliberarea hormonilor de creștere.
Sauna utilizată de 2-3 ori pe săptămână, până la 7 ori pe săptămână, timp de 5-20 de minute pe sesiune, la aproximativ 80-100 ℃ (176-212℉) poate fi benefică pentru sănătatea cardiovasculară, îmbunătățește starea de spirit prin eliberarea de dinorfine și endorfine și îmbunătățește răspunsurile la stres.
Expunerea la căldură este o formă de hormesis, un stres ușor, tolerabil pentru organism, care duce la o adaptare pozitivă.
Utilizarea unei saune poate reduce nivelul cortizolului sau al stresului și poate încuraja activarea căilor de reparare a ADN-ului și a longevității, prin creșterea proteinelor de șoc termic.
Stresul termic creat în organism de utilizarea saunei reglează proteinele de șoc greu intracelulare, prevenind agregarea proteinelor, ajutând la transportul proteinelor de reparare și îmbunătățind sistemul imunitar.
Stresul termic are beneficii uriașe pentru sănătatea generală a tuturor oamenilor. Studiile arată că stresul termic în timp util ar putea aduce beneficii mai tipice exercițiilor fizice pentru persoanele care nu pot face exerciții fizice în măsura recomandată din cauza vârstei, a leziunilor și/sau a bolilor cronice.
Expunere la frig
Expunerea deliberată la frig are beneficii și pentru proteinele de șoc termic. Un studiu privind expunerea la frig a constatat că temperaturile scăzute au dus la introducerea selectivă în țesuturi a proteinelor de șoc termic în țesutul adipos brun, ceea ce are beneficii metabolice semnificative.
Această expresie a proteinelor de șoc termic indusă de frig are beneficii specifice prin faptul că există o legătură sporită a factorilor lor de transcripție la ADN.
De luat la pachet
În concluzie, lumea proteinelor de șoc termic (HSP) se dovedește a fi o cale promițătoare în încercarea noastră de a înțelege și combate mai bine bolile neurodegenerative.
Aceste proteine de stres, care au sarcina de a refolosi proteinele denaturate și de a menține echilibrul celular, oferă descoperiri potențiale în dezvoltarea terapiilor.
Pe măsură ce deslușim rețeaua biologică complexă, țintirea proteinelor de șoc termic ar putea deține cheia pentru abordarea complexității bolilor neurodegenerative, oferind speranță pentru tratamente îmbunătățite și un viitor mai luminos.
Referințe
Factori bacterieni Sigma și factori anti-Sigma: Structură, funcție și distribuție - PMC.
Protocoale de expunere deliberată la căldură pentru sănătate și performanță - Huberman Lab
Proteinele extracelulare de șoc termic și cancerul: Noi perspective - PMC
Proteina de șoc termic - o prezentare generală | ScienceDirect Topics
Proteinele șoc termic: repararea ADN-ului | Oncogene.
Proteinele de șoc termic: o țintă terapeutică demnă de luat în considerare - PMC.
Proteine de șoc termic: O analiză a chaperonilor moleculari - ScienceDirect
Proteina de șoc termic - Wikipedia
Nivelurile serice crescute ale HSP70 sunt asociate cu durata diabetului - PMC
Proteinele de stres (șoc termic) | Circulation Research
Transcripție (biologie) - Wikipedia
Disclaimer
Conținutul acestui articol este furnizat doar în scop informativ și nu este destinat să înlocuiască sfatul, diagnosticul sau tratamentul medical profesional. Este întotdeauna recomandat să consultați un furnizor calificat de asistență medicală înainte de a face orice modificări legate de sănătate sau dacă aveți întrebări sau preocupări cu privire la sănătatea dumneavoastră. Anahana nu este responsabilă pentru eventualele erori, omisiuni sau consecințe care pot rezulta din utilizarea informațiilor furnizate.

By: Clint Johnson
Clint este forța motrice și fondatorul Anahana. Clint predă Yoga, Pilates, respirație conștientă și meditație, adresându-se unei comunități globale de studenți și profesori.
