Table of Contents
Białka szoku cieplnego ujawnione: Dowiedz się o istotnej roli tych molekularnych przyzwoitek w zdrowiu komórkowym, reakcji na stres i ich potencjalnym wpływie na różne schorzenia.
Kluczowe wnioski
- Definicja: Białka szoku cieplnego (HSP) to białka stresu, które pomagają w przetrwaniu komórek, chroniąc je przed stresem, takim jak ciepło i toksyny.
- Funkcja: HSP pomagają w fałdowaniu białek w retikulum endoplazmatycznym i mają kluczowe znaczenie dla naprawy komórkowej.
- Rodzaje: Inne białka szoku cieplnego pełnią różne funkcje, w tym wspomagają komórki prezentujące antygen w odpowiedzi immunologicznej.
- Korzyści zdrowotne: HSP są powiązane z długowiecznością i ochroną przed chorobami poprzez odpowiedź transkrypcyjną szoku cieplnego.
- Aktywacja: Aktywności takie jak ćwiczenia i korzystanie z sauny stymulują produkcję tych białek.
- Badania: Badania koncentrują się na ich roli w leczeniu chorób neurodegeneracyjnych i nowotworów.
Czym są białka szoku cieplnego?
Białka szoku cieplnego (HSP) to grupa białek występujących w prawie wszystkich żywych organizmach, od bakterii po ludzi. Fakt ten sugeruje, że białka te wyewoluowały wcześnie i odgrywają znaczącą rolę u większości istot.
Są one produkowane w odpowiedzi na ekspozycję komórek na stresujące warunki. Te stresujące warunki to przede wszystkim szok termiczny.
Wiemy jednak, że białka szoku cieplnego są również wytwarzane podczas ekspozycji na zimno i światło UV oraz podczas gojenia się ran lub przebudowy tkanek.
Białka szoku cieplnego są podzielone pod względem masy cząsteczkowej, struktury i funkcji na pięć głównych rodzin: HSP100, 90, 70, 60 i małe białka szoku cieplnego (sHsp). Każda liczba odnosi się do odpowiedniej wagi białka w kilodaltonach.
Małe białko ubikwityna ma niewielki rozmiar ośmiu kilodaltonów i ma cechy białka szoku cieplnego, oznaczając białka do degradacji.
Stwierdzono, że sHsp działają jako chaperony o niskiej masie cząsteczkowej, pomagają regulować montaż cytoszkieletu i są związane z miofibrylami.
Bardziej powszechne białka stresu mogą wzrastać do wysokich poziomów w komórkach białek szoku cieplnego, ale mogą również występować na niskich lub umiarkowanych poziomach w komórkach, które nie były narażone na stres, co pokazuje, że odgrywają one rolę w normalnych komórkach.
U większości ssaków Hsp90 i Hsp60 są obfite w normalnych temperaturach, ale białko szoku cieplnego 70 (Hsp70) jest ledwo wykrywalne, ale jest dalej indukowane przez stres.
Na przykład w Escherichia coli, w normalnych temperaturach, Hsp6p i Hsp70 stanowią 1,5% całkowitego białka komórkowego, ale po szoku termicznym stanowią 30%. Wykazano, że ten rodzaj HSP zwiększa ekspresję wewnątrzkomórkowych cząsteczek adhezji komórkowej i cząsteczek adhezji komórek naczyniowych.
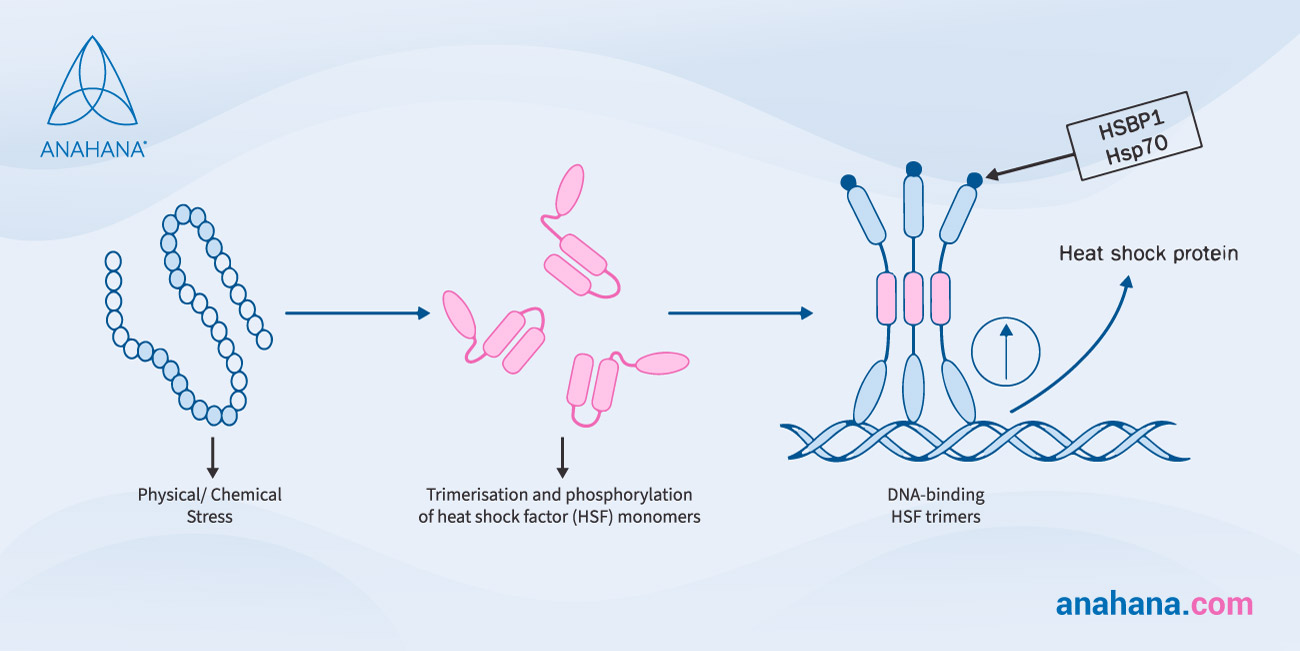
Niektóre białka szoku cieplnego działają jako przyzwoitki, stabilizując nowe białka podczas ich tworzenia, zapewniając prawidłowe fałdowanie lub ponowne fałdowanie białek uszkodzonych przez stres cieplny. Proces ten jest regulowany transkrypcyjnie, gdzie segment DNA jest kopiowany do RNA.
Białka szoku cieplnego są regulowane w górę, co jest procesem, w którym komórka dramatycznie zwiększa ilość składnika komórkowego, takiego jak RNA lub białko, po przejściu bodźca zewnętrznego.
Ta regulacja w górę jest kluczowa dla odpowiedzi na szok cieplny i jest indukowana przez czynniki transkrypcyjne zwane czynnikami szoku cieplnego (HSF).
Odkrycie
Białka szoku cieplnego zostały po raz pierwszy odkryte przypadkowo w 1962 roku przez włoskiego genetyka Ferruccio Ritossę.
Zostały one nazwane białkami szoku cieplnego ze względu na ich zwiększoną syntezę po szoku cieplnym u muszek owocowych, które badał Ritossa.
Zauważył, że ciepło i metaboliczny rozprzęgacz 2,4-dinitrofenol powodowały szczególny wzór "dmuchania" w chromosomach u muszek owocowych cierpiących na szok termiczny.
To puchnięcie wyrażało białka szoku cieplnego, zwane również białkami stresu. W 1974 roku Alfred Tissieres, Herschel Mitchell i Ursula Tracy odkryli, że szok termiczny zachęca do produkcji pewnej mniejszej liczby białek i hamuje produkcję większej ilości białek.
Odkrycie to zapoczątkowało większą liczbę badań nad tymi biochemicznymi odkryciami dotyczącymi indukcji szoku cieplnego i jego roli.
Funkcja białek szoku cieplnego
Białka szoku cieplnego pełnią kilka różnych ról. Pięć znaczących ról jest ważnych, aby zrozumieć regulację stresu, rolę przyzwoitki, zarządzanie białkami, zdrowie układu sercowo-naczyniowegoi odporność.
Regulacja w stresie
Produkcja dużych ilości białek szoku cieplnego, znanych również jako białka stresu, jest wyzwalana przez stresy środowiskowe i metaboliczne, takie jak:
- Infekcja
- Zapalenie
- Ćwiczenie
- Światło UV
- Głód
- Brak tlenu lub wody (niedotlenienie)
- Niedobór azotu w roślinach
- Narażenie na działanie szkodliwych substancji, takich jak etanol, arsen, metale śladowe, etanol, nikotyna
- Stres chirurgiczny i czynniki wirusowe
Ta regulacja białek szoku cieplnego podczas stresu środowiskowego jest częścią odpowiedzi na stres.
Podczas tych stresów środowiskowych, białka błony zewnętrznej nie mogą się złożyć i prawidłowo dopasować do błony zewnętrznej, a zatem gromadzą się w przestrzeni peryplazmatycznej, gdzie białka błony zewnętrznej są wykrywane przez proteazę błony wewnętrznej, która przekazuje sygnał przez błonę do czynnika transkrypcyjnego sigmaE.
Czynniki Sigma to podjednostki polimerazy RNA, które odgrywają kluczową rolę w inicjacji transkrypcji, pomagając w początkowych etapach syntezy RNA.
Jednak niektórzy badacze odkrywają, że białka szoku cieplnego są rekrutowane, gdy występuje wzrost uszkodzonych lub nieprawidłowych białek.
Niektóre bakteryjne białka szoku cieplnego przechodzą ten proces regulacji poprzez rekrutację mechanizmu obejmującego termometry RNA. Te termometry RNA regulują ekspresję genów podczas szoku cieplnego i odpowiedzi na szok zimna.
Ważnego odkrycia dokonali naukowcy, którzy stwierdzili, że gdy "łagodny szok cieplny" został zastosowany u muszek owocowych, indukował on ekspresję genów szoku cieplnego, wpływając głównie na translację informacyjnego RNA, a nie na transkrypcję RNA.
Proces ten znacznie zwiększył ich przeżywalność po szoku termicznym w wyższej temperaturze.
Odwrotnie, białka szoku cieplnego były również syntetyzowane u muszek owocowych, gdy były narażone na przedłużoną ekspozycję na zimno, a nie na szok cieplny.
Wynik ten jest znaczący, ponieważ pokazuje, że w przypadku wstępnej ekspozycji na łagodny szok termiczny, istnieją kolejne korzyści w zapobieganiu uszkodzeniom i śmierci w przypadku ekspozycji na kolejny szok termiczny i ekspozycję na zimno.
Rola przyzwoitek molekularnych
Niektóre białka szoku cieplnego działają również jako wewnątrzkomórkowe przyzwoitki molekularne dla innych białek, odgrywając kluczową rolę w interakcjach między składaniem białek, zapewniając odpowiednią konformację białek i zapobiegając ich agregacji.
Białka szoku cieplnego działają jako stabilizatory w rozkładaniu nieprawidłowo sfałdowanych białek i pomagają w transporcie białek przez błony komórkowe.
Ponieważ ta rola przyzwoitki molekularnej jest kluczowa w utrzymaniu białek, białka szoku cieplnego zostały znalezione w prawie wszystkich organizmach na niskim poziomie.
Zarządzanie
Gdy białka szoku cieplnego nie są narażone na stresory środowiskowe, działają jako "monitory", monitorując białka komórek.
Proces monitorowania jest częścią systemu naprawczego komórki, zwanego komórkową odpowiedzią na stres lub reakcją na szok termiczny; polega on na transportowaniu starych białek do proteasomu komórki i pomaganiu nowo zsyntetyzowanym białkom w prawidłowym fałdowaniu.
Białka szoku cieplnego wydają się być bardziej podatne na samodegradację w porównaniu z innymi białkami ze względu na ich działanie proteolityczne, które polega na rozpadzie białek na polipeptydy lub aminokwasy podczas stresu oksydacyjnego, agresji proteolitycznej lub stanu zapalnego.
Układ sercowo-naczyniowy
Rola białek szoku cieplnego w układzie sercowo-naczyniowym jest znacząca, a Hsp90, Hsp84, Hsp70, Hsp27, Hsp20 i krystalina ɑB odgrywają ważną rolę w układzie sercowo-naczyniowym.
Role te obejmują wiązanie śródbłonkowej syntazy tlenku azotu i cyklazy guanylanowej, które są zaangażowane w relaksację naczyń, zarządzanie stresem oksydacyjnym i czynnikami fizjologicznymi oraz regulację morfogenezy serca. HSP odgrywają również rolę w:
- Rozwój fenotypu mięśni gładkich (rodzaj mięśni w układzie oddechowym, moczowym, pokarmowym i rozrodczym)
- Zapobieganie agregacji płytek krwi
- Funkcja miocytów serca
- Zapobieganie apoptozie po urazie niedokrwiennym
- Funkcjonowanie mięśni szkieletowych
- Odpowiedź mięśni na insulinę
Białka szoku cieplnego mogą być również potencjalnymi celami terapeutycznymi w celu wzmocnienia obrony naczyniowej i opóźnienia lub uniknięcia powikłań klinicznych związanych z aterotrombozą - chorobą sercowo-naczyniową.
Odporność
Białka szoku cieplnego odgrywają rolę w odporności, ponieważ wiążą się z całymi białkami i peptydami. Ta interakcja jest jednak rzadka, głównie w przypadku Hsp70, Hsp90 i gp96 oraz ich miejsc wiązania peptydów zawierających tę zdolność.
Dodatkowo, białka szoku cieplnego stymulują receptory immunologiczne i ich rolę w prawidłowym składaniu białek zaangażowanych w prozapalne szlaki sygnałowe.
Znaczenie medyczne
Czynnik szoku cieplnego 1 (HSF-1)
HSF-1 jest czynnikiem transkrypcyjnym, który odgrywa rolę w utrzymywaniu i zwiększaniu ekspresji Hsp70, którą naukowcy odkryli jako wieloaspektowy modyfikator kancerogenezy. Kancerogeneza to proces, w którym normalne komórki przekształcają się w komórki nowotworowe.
W badaniu myszy z nokautem HSF-1, u których naukowcy zastosowali miejscowo mutagen (środek chemiczny, który trwale uszkadza materiał genetyczny) DMBA, myszy HSF-1 miały obniżony wskaźnik nowotworów skóry.
Ponadto stwierdzono, że hamowanie HSF-1 przez aptamer RNA osłabia sygnalizację mitogenną i rozpoczyna apoptozę, program śmierci komórek nowotworowych.
Cukrzyca
Cukrzyca jest chorobą immunologiczną z nadmiarem glukozy (hiperglikemią), zwykle spowodowaną niedoborem insuliny. Nowe badania sugerują korelację między Hsp70, Hsp60 i cukrzycą.
Niektóre badania pokazują, że stosunek eHsp70 i iHsp70 może wpływać na cukrzycę, wskazując, że eHsp70 i iHsp70 są biomarkerami stanu glikemicznego i zapalnego pacjentów.
Co więcej, w badaniu analizowano poziom Hsp70 w surowicy krwi u pacjentów z cukrzycą w porównaniu z pacjentami kontrolnymi (bez cukrzycy) i stwierdzono, że pacjenci z cukrzycą mieli znacznie wyższy poziom Hsp70, a nawet wyższy u pacjentów, którzy chorowali na cukrzycę przez ponad pięć lat niż u tych nowo zdiagnozowanych.
Odkrycie to sugeruje, że poziomy Hsp70 w surowicy krwi wskazują na zaburzenia metaboliczne w przebiegu cukrzycy.
Rak
Białka szoku cieplnego mogą odgrywać kluczową rolę w identyfikacji nowotworów. Wykazano, że wysoka ekspresja zewnątrzkomórkowych białek szoku cieplnego wskazuje na wysoce agresywne komórki nowotworowe.
Ponadto koreluje z proliferacją komórek, stadium raka i złymi wynikami klinicznymi, co wskazuje na potencjalne wykorzystanie ekspresji białka szoku cieplnego w procesie diagnozy raka. Onkolodzy zaczęli nawet wykorzystywać białka szoku cieplnego do diagnozowania raka jamy ustnej.
Techniki takie jak punktowy test immunologiczny i ELISA wykazały potencjał w diagnostyce raka. Naukowcy ustalili, że przeciwciała fagowe specyficzne dla HSP są korzystne w diagnostyce raka w probówce (in vitro).
Wykazano również, że białka szoku cieplnego oddziałują z adaptacjami nowotworowymi, takimi jak oporność na leki, produkcja komórek nowotworowych i długość życia. Regulacja w górę i w dół mikroRNA związanego z rakiem nazywana jest onkokomórkami.
Hsp90 jest jednym z bardziej obiecujących kandydatów do diagnozowania, prognozowania i leczenia raka, a Hsp70, Hsp60 i małe HSP wykazały potencjalne korzyści w leczeniu:
- Choroba neurodegeneracyjna
- Niedokrwienie
- Śmierć komórki
- Autoimmunizacja
- Odrzucenie przeszczepu
- Inne choroby krytyczne
Zastosowania farmaceutyczne
Szczepionki przeciwnowotworowe
Białka szoku cieplnego działają skutecznie jako adiuwanty immunologiczne, które mogą zwiększać odpowiedź immunologiczną na szczepionkę.
Ponadto niektóre badania sugerują, że białka szoku cieplnego mogą być zaangażowane w wiązanie fragmentów białek martwych i złośliwych komórek, takich jak komórki nowotworowe, i dostarczanie ich do układu odpornościowego w celu ich zwalczenia.
Stwierdzono również, że białka szoku cieplnego wpływają na szlaki sygnałowe, które są częścią tworzenia komórek nowotworowych lub kancerogenezy. Ostatecznie, białka szoku cieplnego mogą potencjalnie zwiększyć skuteczność szczepionek przeciwko rakowi. Wyizolowane białka szoku cieplnego z komórek nowotworowych mogą działać jako szczepionka przeciwnowotworowa.
Ponieważ komórki nowotworowe są poddawane ciągłemu stresowi i muszą kontrolować dużą liczbę zmutowanych onkogenów lub genów powodujących raka, wytwarzają one wyjątkową ilość białek szoku cieplnego w komórkach nowotworowych.
Po wyizolowaniu z guza te konkretne białka szoku cieplnego mają repertuar peptydów, który działa jak mapa lub odcisk palca komórek nowotworowych, z których pochodzą.
Te białka szoku cieplnego mogą być stosowane u pacjentów, aby pomóc w walce z nowotworem w celu jego regresji.
Terapie przeciwnowotworowe
Białka szoku cieplnego ulegają silnej ekspresji wewnątrzkomórkowej w komórkach nowotworowych. Mają one kluczowe znaczenie dla przetrwania komórek nowotworowych, a nawet promują bardziej inwazyjne komórki lub tworzenie przerzutów nowotworów.
Z tego powodu małocząsteczkowe inhibitory białek szoku cieplnego, takich jak Hsp90, mogą potencjalnie stanowić terapię przeciwnowotworową. Naukowcy badają te potencjalne terapie. Jednak testy kliniczne jeszcze się nie zakończyły.
Leczenie autoimmunizacji
Białka szoku cieplnego mogą działać jako wzorce molekularne związane z uszkodzeniami, cząsteczki w komórkach, które są częścią wrodzonej odpowiedzi immunologicznej uwalnianej z komórek umierających w wyniku urazu lub infekcji. Dlatego białka szoku cieplnego mogą pozakomórkowo sprzyjać niektórym chorobom autoimmunologicznym.
Stwierdzono jednak, że białka szoku cieplnego mogą być stosowane u pacjentów z chorobami autoimmunologicznymi w celu wywołania tolerancji immunologicznej i pomocy w leczeniu tych chorób.
Inhibitory Hsp90 mają również potencjał w leczeniu chorób autoimmunologicznych ze względu na ich rolę w prawidłowym fałdowaniu białek prozapalnych. Choroby takie jak reumatoidalne zapalenie stawów i cukrzyca typu 1 mogą być leczone za pomocą terapii autoimmunologicznych.
Aplikacje domowe
Narażenie na ciepło
Celowa ekspozycja na ciepło, zwłaszcza korzystanie z sauny, może odgrywać korzystną rolę w utrzymaniu dobrego zdrowia i przynosi korzyści, począwszy od zdrowia układu sercowo-naczyniowego po uwalnianie hormonów wzrostu.
Sauna używana 2-3 razy w tygodniu, do 7 razy w tygodniu od 5-20 minut na sesję w temperaturze około 80-100 ℃ (176-212 ℉) może korzystnie wpływać na zdrowie układu sercowo-naczyniowego, poprawiać nastrój poprzez uwalnianie dynorfin i endorfin oraz poprawiać reakcje na stres.
Ekspozycja na ciepło jest formą hormezy, łagodnego, tolerowanego stresu dla organizmu, który skutkuje pozytywną adaptacją.
Korzystanie z sauny może obniżyć poziom kortyzolu lub stresu i zachęcić do aktywacji ścieżek naprawy DNA i długowieczności, zwiększając poziom białek szoku cieplnego.
Stres termiczny powstający w organizmie podczas korzystania z sauny zwiększa wewnątrzkomórkową regulację białek szoku ciężkiego, zapobiegając agregacji białek, pomagając w transporcie białek naprawczych i wzmacniając układ odpornościowy.
Stres cieplny przynosi ogromne korzyści dla ogólnego stanu zdrowia wszystkich ludzi. Badania pokazują, że stres cieplny w odpowiednim czasie może przynieść korzyści bardziej typowe dla ćwiczeń dla osób, które nie są w stanie ćwiczyć w zalecanym zakresie ze względu na wiek, urazy i/lub choroby przewlekłe.
Ekspozycja na zimno
Celowa ekspozycja na zimno ma również korzystny wpływ na białka szoku cieplnego. Badanie dotyczące ekspozycji na zimno wykazało, że niskie temperatury spowodowały selektywne tkankowo wprowadzenie białek szoku cieplnego do brązowej tkanki tłuszczowej, co ma znaczące korzyści metaboliczne.
Ta indukowana zimnem ekspresja białek szoku cieplnego ma szczególne zalety, ponieważ występuje zwiększone wiązanie ich czynników transkrypcyjnych z DNA.
Na wynos
Podsumowując, świat białek szoku cieplnego (HSP) okazuje się być obiecującą drogą w naszym dążeniu do lepszego zrozumienia i zwalczania chorób neurodegeneracyjnych.
Te białka stresu, których zadaniem jest ponowne składanie zdenaturowanych białek i utrzymywanie równowagi komórkowej, stanowią potencjalny przełom w opracowywaniu terapii.
W miarę odkrywania skomplikowanej sieci biologicznej, celowanie w białka szoku cieplnego może stanowić klucz do rozwiązania złożoności chorób neurodegeneracyjnych, dając nadzieję na lepsze leczenie i jaśniejszą przyszłość.
Referencje
Bakteryjne czynniki Sigma i czynniki anty-Sigma: Struktura, funkcja i dystrybucja - PMC.
Protokoły celowej ekspozycji na ciepło dla zdrowia i wydajności - Huberman Lab
Pozakomórkowe białka szoku cieplnego i rak: Nowe perspektywy - PMC
Białko szoku cieplnego - przegląd | ScienceDirect Topics
Białka szoku cieplnego: przyzwoite naprawy DNA | Oncogene.
Białka szoku cieplnego: cel terapeutyczny warty rozważenia - PMC.
Białka szoku cieplnego: Przegląd przyzwoitek molekularnych - ScienceDirect
Białko szoku cieplnego - Wikipedia
Podwyższony poziom HSP70 w surowicy jest związany z czasem trwania cukrzycy - PMC
Białka stresu (szoku cieplnego) | Circulation Research
Transkrypcja (biologia) - Wikipedia
Zastrzeżenie
Treść tego artykułu służy wyłącznie celom informacyjnym i nie ma na celu zastąpienia profesjonalnej porady medycznej, diagnozy lub leczenia. Zawsze zaleca się konsultację z wykwalifikowanym pracownikiem służby zdrowia przed dokonaniem jakichkolwiek zmian związanych ze zdrowiem lub w przypadku jakichkolwiek pytań lub wątpliwości dotyczących zdrowia. Anahana nie ponosi odpowiedzialności za jakiekolwiek błędy, pominięcia lub konsekwencje, które mogą wystąpić w wyniku korzystania z dostarczonych informacji.

By: Clint Johnson
Clint jest siłą napędową i założycielem Anahana. Clint uczy jogi, pilatesu, uważnego oddychania i medytacji, obsługując globalną społeczność uczniów i nauczycieli.
