Table of Contents
Les protéines de choc thermique dévoilées : Découvrez le rôle vital de ces chaperons moléculaires dans la santé cellulaire, la réponse au stress et leurs implications potentielles dans diverses pathologies.
Principaux enseignements
- Définition: Les protéines de choc thermique (HSP) sont des protéines de stress qui contribuent à la survie des cellules en les protégeant du stress, comme la chaleur et les toxines.
- Fonction: Les HSP participent au repliement des protéines dans le réticulum endoplasmique et sont essentielles à la réparation cellulaire.
- Types: D'autres protéines de choc thermique ont diverses fonctions, notamment celle d'aider les cellules présentatrices d'antigènes dans la réponse immunitaire.
- Avantages pour la santé: Les HSP sont liées à la longévité et à la protection contre les maladies par le biais de la réponse transcriptionnelle au choc thermique.
- Activation: Des activités telles que l'exercice physique et l'utilisation du sauna stimulent la production de ces protéines.
- Recherche: Les études se concentrent sur leur rôle dans le traitement des maladies neurodégénératives et du cancer.
Que sont les protéines de choc thermique ?
Les protéines de choc thermique (HSP) sont un groupe de protéines présentes dans presque tous les organismes vivants, des bactéries à l'homme. Ce fait suggère que ces protéines ont évolué très tôt et qu'elles jouent un rôle important chez la plupart des êtres humains.
Elles sont produites en réponse à l'exposition des cellules à des conditions stressantes. Ces conditions de stress sont principalement considérées comme des chocs thermiques.
Cependant, nous savons que les protéines de choc thermique sont également produites lors de l'exposition au froid et à la lumière UV, ainsi que lors de la cicatrisation d'une plaie ou du remodelage d'un tissu.
Les protéines de choc thermique sont divisées en fonction de leur poids moléculaire, de leur structure et de leur fonction en cinq grandes familles : HSP100, 90, 70, 60 et petites protéines de choc thermique (sHsp). Chaque chiffre fait référence au poids respectif de la protéine en kilodaltons.
La petite protéine ubiquitine est de petite taille (huit kilodaltons) et possède des caractéristiques de protéine de choc thermique, marquant les protéines pour la dégradation.
Une sHsp possède un domaine alpha-cristallin d'environ 80 acides aminés. On a découvert que les sHsp agissent comme des chaperons de faible poids moléculaire, aident à réguler l'assemblage du cytosquelette et sont associées aux myofibrilles.
Les protéines de stress les plus courantes peuvent augmenter jusqu'à atteindre des niveaux élevés dans les cellules à protéines de choc thermique, mais elles peuvent également exister à des niveaux faibles à modérés dans les cellules qui n'ont pas été exposées au stress, ce qui prouve qu'elles jouent un rôle dans les cellules normales.
Chez la plupart des mammifères, les protéines Hsp90 et Hsp60 sont abondantes à des températures normales, tandis que la protéine de choc thermique 70 (Hsp70) est à peine détectable, mais elle est davantage induite par le stress.
Chez Escherichia coli, par exemple, à des températures normales, Hsp6p et Hsp70 représentent 1,5 % des protéines cellulaires totales, mais augmentent de 30 % après un choc thermique. Il a été démontré que ce type de HSP renforce l'expression des molécules d'adhésion cellulaire intracellulaire et des molécules d'adhésion cellulaire vasculaire.
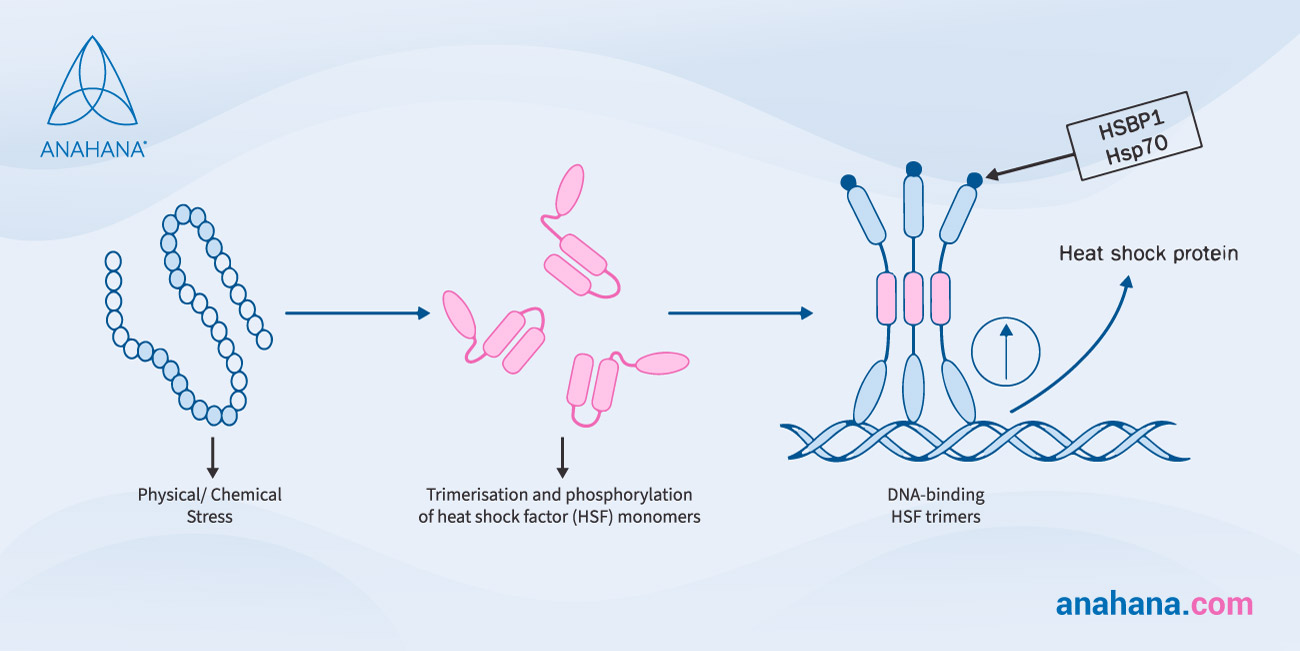
Certaines protéines de choc thermique jouent le rôle de chaperon en stabilisant les nouvelles protéines lors de leur création et en veillant à ce qu'elles replient ou replient correctement les protéines endommagées par le stress thermique. Ce processus est régulé par la transcription, c'est-à-dire qu'un segment d'ADN est copié en ARN.
Les protéines de choc thermique sont régulées à la hausse, un processus par lequel la cellule augmente considérablement la quantité d'un composant cellulaire, comme l'ARN ou la protéine, après avoir subi un stimulus externe.
Cette régulation est cruciale pour la réponse au choc thermique et est induite par les facteurs de transcription appelés facteurs de choc thermique (HSF).
Découverte
Les protéines de choc thermique ont été découvertes par hasard en 1962 par le généticien italien Ferruccio Ritossa.
Elles ont été appelées protéines de choc thermique en raison de leur synthèse accrue après un choc thermique chez les mouches des fruits étudiées par Ritossa.
Il a constaté que la chaleur et le découpleur métabolique 2,4-dinitrophénol provoquaient un modèle particulier de "bouffées" dans les chromosomes des drosophiles souffrant d'un choc thermique.
Cette bouffée exprime des protéines de choc thermique, également appelées protéines de stress. En 1974, Alfred Tissieres, Herschel Mitchell et Ursula Tracy ont découvert que le choc thermique favorise la production d'un certain nombre de protéines plus petites et supprime la production d'un plus grand nombre de protéines.
Cette découverte a donné le coup d'envoi à un grand nombre d'études sur ces résultats biochimiques concernant l'induction du choc thermique et son rôle.
La fonction des protéines de choc thermique
Les protéines de choc thermique ont plusieurs rôles différents. Il est important de comprendre cinq rôles significatifs : régulation en cas de stress, rôle de chaperon, gestion des protéines, santé cardiovasculaire et immunité.
Régulation à la hausse en cas de stress
La production de grandes quantités de protéines de choc thermique, également connues sous le nom de protéines de stress, est déclenchée par des stress environnementaux et métaboliques tels que.. :
- Infection
- Inflammation
- Exercice
- Lumière UV
- La famine
- Manque d'oxygène ou d'eau (hypoxie)
- Carence en azote dans les plantes
- Exposition à des substances nocives telles que l'éthanol, l'arsenic, les métaux traces, l'éthanol, la nicotine
- Stress chirurgical et agents viraux
Cette régulation des protéines de choc thermique en cas de stress environnemental fait partie de la réponse au stress.
Lors de ces stress environnementaux, les protéines de la membrane externe ne peuvent pas se replier et s'insérer correctement dans la membrane externe et s'accumulent donc dans l'espace périplasmique où les protéines de la membrane externe sont détectées par une protéase de la membrane interne, qui transmet le signal à travers la membrane au facteur de transcription sigmaE.
Les facteurs Sigma sont des sous-unités de l'ARN polymérase qui jouent un rôle essentiel dans l'initiation de la transcription, ce qui contribue aux premières étapes de la synthèse de l'ARN.
Pourtant, certains chercheurs constatent que les protéines de choc thermique sont recrutées lorsqu'il y a une augmentation des protéines endommagées ou anormales.
Certaines protéines de choc thermique bactériennes subissent ce processus de régulation en recrutant un mécanisme impliquant des thermomètres ARN. Ces thermomètres à ARN régulent l'expression des gènes lors des réponses aux chocs thermiques et aux chocs froids.
Une découverte importante a été faite par des chercheurs qui ont constaté que lorsqu'un "prétraitement de choc thermique léger" était appliqué à des mouches des fruits, il induisait l'expression de gènes de choc thermique, affectant principalement la traduction de l'ARN messager et non la transcription de l'ARN.
Ce processus a permis d'améliorer considérablement leur survie après un choc thermique à haute température.
À l'inverse, des protéines de choc thermique ont également été synthétisées chez les drosophiles lorsqu'elles étaient exposées à une exposition prolongée au froid plutôt qu'à un choc thermique.
Ce résultat est significatif car il montre que lorsqu'ils sont exposés à un prétraitement de choc thermique léger, ils bénéficient successivement de la prévention des dommages et de la mort lorsqu'ils sont exposés à un choc thermique suivant et à une exposition au froid.
Rôle de chaperon moléculaire
Certaines protéines de choc thermique agissent également comme des chaperons moléculaires intracellulaires pour d'autres protéines, jouant un rôle central dans les interactions entre le repliement des protéines, assurant la conformation appropriée des protéines et empêchant l'agrégation des protéines.
Les protéines de choc thermique agissent comme des stabilisateurs en dépliant les protéines mal repliées et aident à transporter les protéines à travers les membranes cellulaires.
Ce rôle de chaperon moléculaire étant crucial pour le maintien des protéines, des protéines de choc thermique ont été trouvées dans presque tous les organismes à des niveaux faibles.
Gestion
Lorsque les protéines de choc thermique ne sont pas exposées à des facteurs de stress environnementaux, elles agissent comme des "moniteurs" en surveillant les protéines des cellules.
Le processus de surveillance fait partie du système de réparation de la cellule, appelé réponse au stress cellulaire ou réponse au choc thermique ; il consiste à transporter les vieilles protéines vers le protéasome de la cellule et à aider les protéines nouvellement synthétisées à se replier correctement.
Les protéines de choc thermique semblent plus enclines à l'autodégradation que les autres protéines en raison de leur action protéolytique, c'est-à-dire la décomposition des protéines en polypeptides ou en acides aminés lors d'un stress oxydatif, d'une agression protéolytique ou d'une inflammation.
Cardiovasculaire
Les protéines de choc thermique jouent un rôle important dans le système cardiovasculaire, notamment Hsp90, Hsp84, Hsp70, Hsp27, Hsp20 et la cristalline ɑB.
Ces rôles comprennent la liaison de l'oxyde nitrique synthase endothéliale et de la guanylate cyclase, qui sont impliquées dans la relaxation vasculaire, la gestion du stress oxydatif et des facteurs physiologiques et la régulation de la morphogenèse cardiaque. Les HSP jouent également un rôle dans :
- Développement d'un phénotype de muscle lisse (type de muscle des systèmes respiratoire, urinaire, gastro-intestinal et reproducteur)
- Prévention de l'agrégation plaquettaire
- Fonction des myocytes cardiaques
- Prévention de l'apoptose après une lésion ischémique
- Fonction des muscles squelettiques
- Réponse musculaire à l'insuline
Les protéines de choc thermique peuvent également constituer des cibles thérapeutiques potentielles pour renforcer les défenses vasculaires et retarder ou éviter les complications cliniques liées à l'athérothrombose, une maladie cardiovasculaire.
Immunité
Les protéines de choc thermique jouent un rôle dans l'immunité car elles se lient à des protéines entières et à des peptides. Cette interaction est toutefois rare, puisque ce sont principalement les Hsp70, Hsp90 et gp96, ainsi que leurs sites de liaison aux peptides, qui possèdent cette capacité.
En outre, les protéines de choc thermique stimulent les récepteurs immunitaires et leur rôle dans le repliement correct des protéines impliquées dans les voies de signalisation pro-inflammatoires.
Signification médicale
Facteur de choc thermique 1 (HSF-1)
HSF-1 est un facteur de transcription qui joue un rôle dans le maintien et la régulation de l'expression de Hsp70, dont les chercheurs ont découvert qu'elle était un modificateur à multiples facettes de la cancérogenèse. La cancérogenèse est le processus par lequel des cellules normales se transforment en cellules cancéreuses.
Dans une étude portant sur des souris HSF-1 knockout auxquelles les chercheurs ont appliqué un mutagène topique (un agent chimique qui endommage de façon permanente le matériel génétique) de DMBA, les souris HSF-1 présentaient un taux réduit de tumeurs cutanées.
En outre, il a été constaté que l'inhibition du HSF-1 par un aptamère ARN atténue la signalisation mitogénique et déclenche l'apoptose, le programme de mort cellulaire des cellules cancéreuses.
Diabète sucré
Le diabète sucré est une maladie immunitaire caractérisée par un excès de glucose (hyperglycémie), généralement due à une carence en insuline. De nouvelles recherches suggèrent une corrélation entre Hsp70, Hsp60 et le diabète sucré.
Certaines recherches montrent que le rapport entre eHsp70 et iHsp70 pourrait affecter le diabète sucré, ce qui indique que eHsp70 et iHsp70 sont des biomarqueurs de l'état glycémique et inflammatoire des patients.
En outre, une étude a examiné la Hsp70 dans le sérum sanguin de patients diabétiques par rapport à des patients témoins (non diabétiques) et a constaté que les patients diabétiques présentaient des niveaux de Hsp70 significativement plus élevés, et même plus élevés chez les patients diabétiques depuis plus de cinq ans que chez les patients nouvellement diagnostiqués.
Cette découverte suggère que les niveaux de Hsp70 dans le sérum sanguin indiquent un dérèglement métabolique au cours du diabète.
Cancer
Les protéines de choc thermique peuvent jouer un rôle crucial dans l'identification du cancer. Il a été démontré qu'une forte expression des protéines de choc thermique extracellulaires indique la présence de cellules tumorales très agressives.
En outre, elle est en corrélation avec la prolifération cellulaire, le stade du cancer et les mauvais résultats cliniques, ce qui indique l'utilisation potentielle de l'expression des protéines de choc thermique dans le processus de diagnostic du cancer. Les oncologues ont même commencé à utiliser les protéines de choc thermique pour diagnostiquer le cancer de la bouche.
Des techniques telles que l'immunodosage par points et l'ELISA ont montré leur potentiel dans le diagnostic du cancer. Les chercheurs ont déterminé que les anticorps de phages spécifiques aux HSP sont utiles pour le diagnostic du cancer en éprouvette (in vitro).
Il a également été démontré que les protéines de choc thermique interagissent avec les adaptations du cancer telles que la résistance aux médicaments, la production de cellules tumorales et la durée de vie. L'augmentation et la diminution de la régulation du microARN associé au cancer sont appelées oncomirs.
Hsp90 est l'un des candidats les plus prometteurs pour le diagnostic, le pronostic et le traitement du cancer, et Hsp70, Hsp60 et de petites HSP se sont révélées potentiellement bénéfiques pour le traitement :
- Maladie neurodégénérative
- Ischémie
- Mort cellulaire
- Auto-immunité
- Rejet de greffe
- Autres maladies graves
Applications pharmaceutiques
Vaccins contre le cancer
Les protéines de choc thermique agissent efficacement en tant qu'adjuvants immunologiques, qui peuvent augmenter la réponse immunitaire à un vaccin.
En outre, certaines études suggèrent que les protéines de choc thermique pourraient être impliquées dans la liaison des fragments de protéines des cellules mortes et malignes, telles que les cellules cancéreuses, et les apporter au système immunitaire pour qu'il les combatte.
On a également constaté que les protéines de choc thermique ont un impact sur les voies de signalisation qui font partie de la formation des cellules cancéreuses ou de la cancérogenèse. Enfin, les protéines de choc thermique peuvent potentiellement accroître l'efficacité des vaccins contre le cancer. Les protéines de choc thermique isolées des cellules tumorales peuvent servir de vaccin anti-tumoral.
Les cellules tumorales étant soumises à un stress permanent et devant chaperonner un grand nombre d'oncogènes mutés ou de gènes cancérigènes, elles créent une quantité exceptionnelle de protéines de choc thermique à l'intérieur des cellules tumorales.
Lorsqu'elles sont isolées de la tumeur, ces protéines de choc thermique particulières ont un répertoire peptidique qui agit comme une carte ou une empreinte digitale des cellules tumorales dont elles proviennent.
Ces protéines de choc thermique peuvent être appliquées au patient pour l'aider à lutter contre la tumeur dans le but de la faire régresser.
Thérapeutique anticancéreuse
Les protéines de choc thermique sont fortement exprimées au niveau intracellulaire dans les cellules cancéreuses. Ils sont essentiels à la survie des cellules cancéreuses et favorisent même l'apparition de cellules plus invasives ou la formation de métastases dans les tumeurs.
C'est pourquoi les petites molécules inhibitrices des protéines de choc thermique telles que Hsp90 ont le potentiel d'être des thérapies anticancéreuses. Les chercheurs étudient ces thérapies potentielles. Cependant, les essais cliniques n'ont pas encore abouti.
Traitement de l'auto-immunité
Les protéines de choc thermique peuvent agir comme des motifs moléculaires associés aux dommages, des molécules présentes dans les cellules qui font partie de la réponse immunitaire innée et qui sont libérées par les cellules qui meurent à la suite d'un traumatisme ou d'une infection. Par conséquent, les protéines de choc thermique peuvent favoriser certaines maladies auto-immunes par voie extracellulaire.
Cependant, on a découvert que les protéines de choc thermique peuvent être utilisées chez les patients atteints de maladies auto-immunes pour induire une tolérance immunitaire et aider à traiter ces maladies.
Les inhibiteurs de Hsp90 ont également le potentiel de traiter les maladies auto-immunes grâce à leur rôle dans le repliement correct des protéines pro-inflammatoires. Des maladies telles que la polyarthrite rhumatoïde et le diabète de type 1 peuvent être traitées par des traitements auto-immunitaires.
Applications à domicile
Exposition à la chaleur
L'exposition délibérée à la chaleur, en particulier l'utilisation du sauna, peut jouer un rôle bénéfique dans le maintien d'une bonne santé et présente des avantages allant de la santé cardiovasculaire à la libération d'hormones de croissance.
Le sauna utilisé 2 à 3 fois par semaine, jusqu'à 7 fois par semaine pendant 5 à 20 minutes par séance à une température d'environ 80 à 100℃ (176 à 212℉) peut être bénéfique pour la santé cardiovasculaire, améliorer l'humeur en libérant des dynorphines et des endorphines, et améliorer les réponses au stress.
L'exposition à la chaleur est une forme d'hormèse, un stress léger et tolérable pour l'organisme qui entraîne une adaptation positive.
L'utilisation d'un sauna peut réduire les niveaux de cortisol ou de stress et encourager l'activation des voies de réparation de l'ADN et de longévité, en augmentant les protéines de choc thermique.
Le stress thermique créé dans le corps par l'utilisation du sauna augmente les protéines de choc lourdes intracellulaires, empêchant l'agrégation des protéines, aidant à transporter les protéines de réparation et renforçant le système immunitaire.
Le stress thermique a des effets bénéfiques considérables sur la santé globale de tous les individus. Des études montrent qu'un stress thermique ponctuel pourrait apporter des avantages plus typiques de l'exercice physique aux personnes incapables de faire l'exercice recommandé en raison de leur âge, d'une blessure et/ou d'une maladie chronique.
Exposition au froid
L'exposition délibérée au froid a également des effets bénéfiques sur les protéines de choc thermique. Une étude sur l'exposition au froid a montré que les températures froides entraînaient l'introduction sélective de protéines de choc thermique dans le tissu adipeux brun, ce qui présente des avantages métaboliques significatifs.
Cette expression des protéines de choc thermique induite par le froid présente des avantages spécifiques en ce sens qu'elle renforce la liaison de leurs facteurs de transcription à l'ADN.
À emporter
En conclusion, le monde des protéines de choc thermique (HSP) s'avère être une voie prometteuse dans notre quête pour mieux comprendre et combattre les maladies neurodégénératives.
Ces protéines de stress, chargées de replier les protéines dénaturées et de maintenir l'équilibre cellulaire, offrent des possibilités de percée dans le développement de thérapies.
À mesure que nous démêlons l'écheveau biologique complexe, le ciblage des protéines de choc thermique pourrait être la clé pour aborder les complexités des maladies neurodégénératives, offrant l'espoir de meilleurs traitements et d'un avenir plus radieux.
Références
Facteurs sigma bactériens et facteurs anti-sigma : Structure, fonction et distribution - PMC.
Protocoles d'exposition délibérée à la chaleur pour la santé et la performance - Huberman Lab
Protéines de choc thermique extracellulaires et cancer : Nouvelles perspectives - PMC
Protéine de choc thermique - une vue d'ensemble | ScienceDirect Topics
Protéines de choc thermique : chaperonnage de la réparation de l'ADN | Oncogene.
Les protéines de choc thermique : une cible thérapeutique à considérer - PMC.
Protéines de choc thermique : Une revue des chaperons moléculaires - ScienceDirect
Protéine de choc thermique - Wikipédia
L'augmentation des niveaux de HSP70 dans le sérum est associée à la durée du diabète - PMC
Protéines de stress (choc thermique) | Circulation Research
Transcription (biologie) - Wikipédia
Clause de non-responsabilité
Le contenu de cet article est fourni à titre d'information uniquement et n'est pas destiné à remplacer un avis médical, un diagnostic ou un traitement professionnel. Il est toujours recommandé de consulter un fournisseur de soins de santé qualifié avant de procéder à des changements liés à la santé ou si vous avez des questions ou des inquiétudes concernant votre santé. Anahana n'est pas responsable des erreurs, omissions ou conséquences pouvant résulter de l'utilisation des informations fournies.

By: Clint Johnson
Clint est la force motrice et le fondateur d'Anahana. Clint enseigne le yoga, le Pilates, la respiration consciente et la méditation à une communauté mondiale d'étudiants et d'enseignants.
