Table of Contents
Hitzeschockproteine enthüllt: Erfahren Sie mehr über die lebenswichtige Rolle dieser molekularen Chaperone für die Zellgesundheit, die Stressreaktion und ihre möglichen Auswirkungen auf verschiedene Krankheiten.
Wichtigste Erkenntnisse
- Definition: Hitzeschockproteine (HSP) sind Stressproteine, die das Überleben der Zellen unterstützen, indem sie sie vor Stress, wie Hitze und Toxinen, schützen.
- Funktion: HSPs helfen bei der Proteinfaltung im endoplasmatischen Retikulum und sind entscheidend für die Zellreparatur.
- Typen: Andere Hitzeschockproteine haben verschiedene Funktionen, darunter die Unterstützung von Antigen-präsentierenden Zellen bei der Immunantwort.
- Gesundheitliche Vorteile: HSPs werden durch die transkriptionelle Reaktion auf Hitzeschocks mit Langlebigkeit und Krankheitsschutz in Verbindung gebracht.
- Aktivierung: Aktivitäten wie Sport und Saunabesuche regen die Produktion dieser Proteine an.
- Forschung: Die Studien konzentrieren sich auf ihre Rolle bei der Behandlung von neurodegenerativen Krankheiten und Krebs.
Was sind Hitzeschockproteine?
Hitzeschockproteine (HSP) sind eine Gruppe von Proteinen, die in fast allen lebenden Organismen, von Bakterien bis zum Menschen, vorkommen. Diese Tatsache deutet darauf hin, dass sich diese Proteine schon früh entwickelt haben und bei den meisten Lebewesen eine wichtige Rolle spielen.
Sie werden als Reaktion auf die Exposition von Zellen gegenüber Stressbedingungen gebildet. Diese Stressbedingungen wurden in erster Linie als Hitzeschock verstanden.
Wir wissen jedoch, dass Hitzeschockproteine auch bei Kälte und UV-Licht sowie bei der Wundheilung und beim Gewebeumbau gebildet werden.
Hitzeschockproteine werden nach Molekulargewicht, Struktur und Funktion in fünf große Familien unterteilt: HSP100, 90, 70, 60 und kleine Hitzeschockproteine (sHsp). Jede Zahl bezieht sich auf das jeweilige Gewicht des Proteins in Kilodalton.
Das kleine Protein Ubiquitin hat eine geringe Größe von acht Kilodalton und weist Eigenschaften eines Hitzeschockproteins auf, das Proteine für den Abbau markiert.
Ein sHsp hat eine Alpha-Crystallin-Domäne mit etwa 80 Aminosäuren. sHsp fungieren als Chaperone mit niedrigem Molekulargewicht, helfen bei der Regulierung des Zytoskelettaufbaus und sind mit Myofibrillen verbunden.
Die häufiger vorkommenden Stressproteine können in Hitzeschockprotein-Zellen auf hohe Werte ansteigen, aber auch in Zellen, die keinem Stress ausgesetzt waren, können sie in geringen bis mäßigen Mengen vorkommen, was zeigt, dass sie in normalen Zellen eine Rolle spielen.
Bei den meisten Säugetieren sind Hsp90 und Hsp60 bei normalen Temperaturen reichlich vorhanden, während das Hitzeschockprotein 70 (Hsp70) kaum nachweisbar ist, aber durch Stress zusätzlich induziert wird.
In Escherichia coli beispielsweise machen Hsp6p und Hsp70 bei normalen Temperaturen 1,5 % des gesamten Zellproteins aus, nach einem Hitzeschock jedoch bis zu 30 %. Es hat sich gezeigt, dass diese Art von HSP die Expression von intrazellulären Zelladhäsionsmolekülen und vaskulären Zelladhäsionsmolekülen verstärkt.
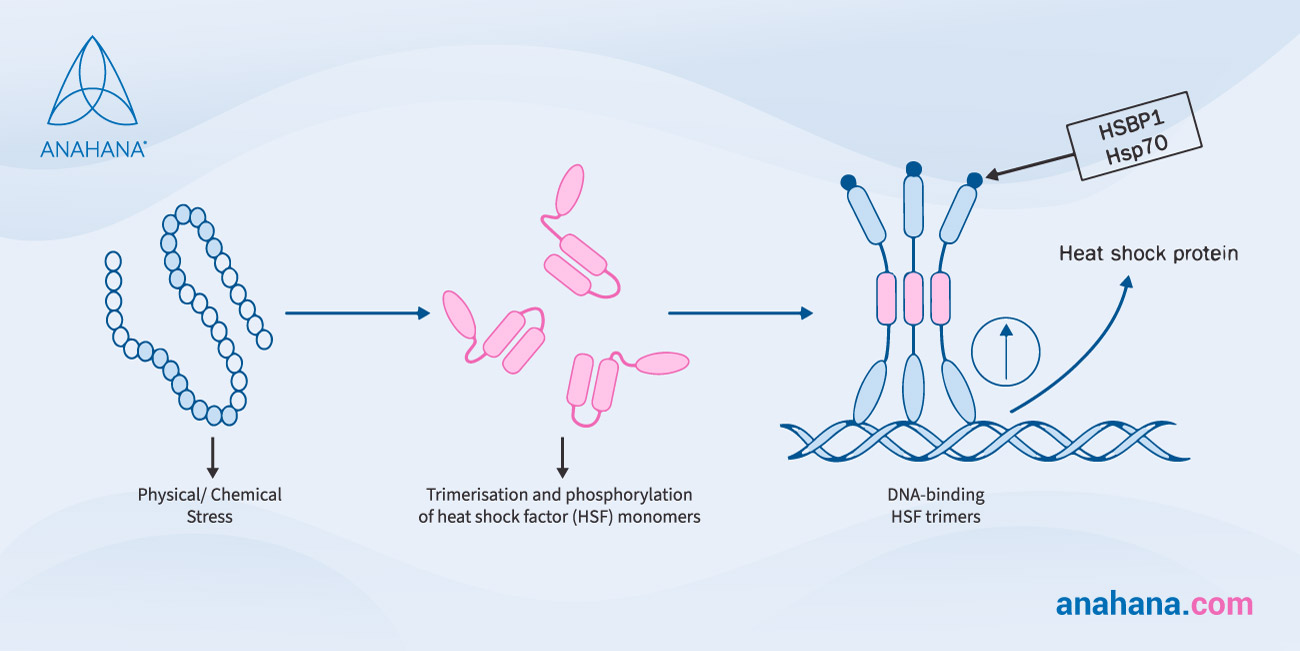
Bestimmte Hitzeschockproteine fungieren als Chaperone, indem sie neue Proteine bei ihrer Entstehung stabilisieren, indem sie dafür sorgen, dass durch Hitzestress geschädigte Proteine korrekt gefaltet oder rückgefaltet werden. Dieser Prozess wird durch die Transkription reguliert, bei der ein DNA-Abschnitt in RNA kopiert wird.
Hitzeschockproteine werden hochreguliert, ein Prozess, bei dem die Zelle die Menge eines zellulären Bestandteils wie RNA oder Protein drastisch erhöht, nachdem sie einem äußeren Reiz ausgesetzt war.
Diese Hochregulierung ist entscheidend für die Hitzeschockreaktion und wird durch die Transkriptionsfaktoren, die so genannten Hitzeschockfaktoren (HSF), ausgelöst.
Entdeckung
Hitzeschockproteine wurden erstmals 1962 von dem italienischen Genetiker Ferruccio Ritossa durch Zufall entdeckt.
Sie wurden als Hitzeschockproteine bezeichnet, weil sie in den von Ritossa untersuchten Fruchtfliegen nach einem Hitzeschock vermehrt synthetisiert werden.
Er stellte fest, dass Hitze und der Stoffwechselentkoppler 2,4-Dinitrophenol bei Fruchtfliegen, die unter einem Hitzeschock litten, ein bestimmtes Muster von "Puffing" in den Chromosomen verursachten.
Durch dieses Aufblähen werden Hitzeschockproteine, auch Stressproteine genannt, exprimiert. 1974 entdeckten Alfred Tissieres, Herschel Mitchell und Ursula Tracy, dass ein Hitzeschock die Produktion einer bestimmten kleineren Anzahl von Proteinen fördert und die Produktion einer größeren Menge von Proteinen unterdrückt.
Diese Erkenntnis gab den Anstoß zu einer größeren Anzahl von Studien über diese biochemischen Erkenntnisse zur Induktion des Hitzeschocks und seiner Rolle.
Die Funktion von Hitzeschockproteinen
Hitzeschockproteine haben verschiedene Aufgaben. Es gibt fünf wichtige Funktionen, die es zu verstehen gilt: die Regulierung bei Stress, die Rolle als Chaperon, das Management von Proteinen, die kardiovaskuläre Gesundheit und die Immunität.
Hochregulierung bei Stress
Die Produktion großer Mengen von Hitzeschockproteinen, die auch als Stressproteine bezeichnet werden, wird durch Umwelt- und Stoffwechselstress ausgelöst:
- Infektion
- Entzündung
- Übung
- UV-Licht
- Verhungern
- Mangel an Sauerstoff oder Wasser (Hypoxie)
- Stickstoffmangel bei Pflanzen
- Exposition gegenüber schädlichen Stoffen wie Ethanol, Arsen, Spurenmetallen, Ethanol, Nikotin
- Chirurgische Belastung und virale Erreger
Diese Hochregulierung von Hitzeschockproteinen bei Umweltbelastungen ist Teil der Stressreaktion.
Bei diesen Umweltbelastungen können sich die Proteine der äußeren Membran nicht richtig falten und in die äußere Membran einpassen und sammeln sich daher im periplasmatischen Raum an, wo die Proteine der äußeren Membran von einer Protease der inneren Membran erkannt werden, die das Signal durch die Membran an den Transkriptionsfaktor sigmaE weiterleitet.
Sigma-Faktoren sind Untereinheiten der RNA-Polymerase, die eine entscheidende Rolle bei der Transkriptionsinitiierung spielen und die ersten Schritte der RNA-Synthese unterstützen.
Einige Forscher stellen jedoch fest, dass Hitzeschockproteine rekrutiert werden, wenn es zu einer Zunahme geschädigter oder abnormaler Proteine kommt.
Bestimmte bakterielle Hitzeschockproteine durchlaufen diesen Hochregulierungsprozess, indem sie einen Mechanismus rekrutieren, an dem RNA-Thermometer beteiligt sind. Diese RNA-Thermometer regulieren die Genexpression bei Hitzeschock- und Kälteschockreaktionen.
Eine wichtige Entdeckung wurde von Forschern gemacht, die feststellten, dass eine "milde Hitzeschock-Vorbehandlung" bei Fruchtfliegen die Expression von Hitzeschockgenen auslöste, wobei hauptsächlich die Translation der Boten-RNA und nicht die Transkription der RNA beeinflusst wurde.
Dieser Prozess verbesserte ihr Überleben nach einem Hitzeschock bei höheren Temperaturen erheblich.
Umgekehrt wurden Hitzeschockproteine in Fruchtfliegen auch dann synthetisiert, wenn sie einer längeren Kälteexposition und nicht einem Hitzeschock ausgesetzt waren.
Dieses Ergebnis ist insofern von Bedeutung, als es zeigt, dass die Vorbehandlung mit einem milden Hitzeschock die Schädigung und den Tod der Tiere verhindert, wenn sie anschließend einem Hitzeschock und Kälte ausgesetzt werden.
Rolle als molekulare Chaperone
Bestimmte Hitzeschockproteine fungieren auch als intrazelluläre molekulare Chaperone für andere Proteine, die eine zentrale Rolle bei den Wechselwirkungen zwischen den Proteinfaltungen spielen, die geeignete Proteinkonformation sicherstellen und die Proteinaggregation verhindern.
Hitzeschockproteine wirken als Stabilisatoren bei der Entfaltung fehlgefalteter Proteine und helfen beim Transport von Proteinen durch Zellmembranen.
Da diese Funktion als molekulares Chaperon für die Erhaltung von Proteinen von entscheidender Bedeutung ist, wurden Hitzeschockproteine in fast allen Organismen in geringen Mengen gefunden.
Verwaltung
Wenn Hitzeschockproteine keinen Umweltstressoren ausgesetzt sind, fungieren sie als "Monitore", indem sie die Proteine der Zellen überwachen.
Der Überwachungsprozess ist Teil des Reparatursystems der Zelle, der so genannten zellulären Stressreaktion oder Hitzeschockreaktion; er besteht darin, alte Proteine zum Proteasom der Zelle zu transportieren und neu synthetisierten Proteinen zu helfen, sich richtig zu falten.
Hitzeschockproteine scheinen aufgrund ihrer proteolytischen Wirkung, d. h. der Zerlegung von Proteinen in Polypeptide oder Aminosäuren bei oxidativem Stress, proteolytischer Aggression oder Entzündung, anfälliger für den Selbstabbau zu sein als andere Proteine.
Kardiovaskulär
Hitzeschockproteine spielen eine wichtige Rolle für das Herz-Kreislauf-System: Hsp90, Hsp84, Hsp70, Hsp27, Hsp20 und ɑB-Kristallin spielen alle eine wichtige Rolle für das Herz-Kreislauf-System.
Dazu gehört die Bindung von endothelialer Stickoxid-Synthase und Guanylatcyclase, die an der Gefäßentspannung, der Bewältigung von oxidativem Stress und physiologischen Faktoren sowie der Regulierung der kardialen Morphogenese beteiligt sind. HSPs spielen auch eine Rolle bei:
- Entwicklung des Phänotyps der glatten Muskulatur (Muskeltyp der Atemwege, der Harnwege, des Magen-Darm-Trakts und des Fortpflanzungssystems)
- Verhinderung der Thrombozytenaggregation
- Funktion der Herzmuskelzellen
- Verhinderung der Apoptose nach einer ischämischen Verletzung
- Funktion der Skelettmuskeln
- Insulinreaktion der Muskeln
Hitzeschockproteine könnten auch potenzielle therapeutische Ziele sein, um die Gefäßabwehr zu stärken und klinische Komplikationen zu verzögern oder zu vermeiden, die durch Atherothrombose - eine Herz-Kreislauf-Erkrankung - entstehen.
Immunität
Hitzeschockproteine spielen eine Rolle bei der Immunität, da sie an ganze Proteine und Peptide binden. Diese Interaktion ist jedoch selten, da hauptsächlich Hsp70, Hsp90 und gp96 und ihre Peptidbindungsstellen diese Fähigkeit besitzen.
Darüber hinaus stimulieren Hitzeschockproteine die Immunrezeptoren und ihre Rolle bei der korrekten Faltung von Proteinen, die an den proinflammatorischen Signalwegen beteiligt sind.
Medizinische Bedeutung
Hitzeschockfaktor 1 (HSF-1)
HSF-1 ist ein Transkriptionsfaktor, der eine Rolle bei der Aufrechterhaltung und Hochregulierung der Hsp70-Expression spielt, von der Forscher herausgefunden haben, dass sie die Karzinogenese auf vielfältige Weise beeinflusst. Karzinogenese ist der Prozess, bei dem sich normale Zellen in Krebszellen verwandeln.
In einer Studie mit HSF-1-Knockout-Mäusen, bei der Forscher ein topisches Mutagen (ein chemischer Wirkstoff, der das genetische Material dauerhaft schädigt) von DMBA anwandten, hatten die HSF-1-Mäuse eine geringere Rate an Hauttumoren.
Außerdem wurde festgestellt, dass die Hemmung von HSF-1 durch ein RNA-Aptamer die mitogenen Signale abschwächt und die Apoptose, das Zelltodprogramm von Krebszellen, einleitet.
Diabetes mellitus
Diabetes mellitus ist eine Immunerkrankung mit Glukoseüberschuss (Hyperglykämie), die in der Regel durch einen Insulinmangel ausgelöst wird. Neue Forschungsergebnisse deuten auf einen Zusammenhang zwischen Hsp70, Hsp60 und Diabetes mellitus hin.
Einige Untersuchungen zeigen, dass das Verhältnis von eHsp70 und iHsp70 einen Einfluss auf Diabetes mellitus haben könnte, was darauf hindeutet, dass eHsp70 und iHsp70 Biomarker für den glykämischen und entzündlichen Status der Patienten sind.
Darüber hinaus wurde in einer Studie der Hsp70-Gehalt im Blutserum von Patienten mit Diabetes im Vergleich zu Kontrollpatienten (ohne Diabetes) untersucht, und es wurde festgestellt, dass Patienten mit Diabetes einen deutlich höheren Hsp70-Gehalt aufwiesen, und zwar bei Patienten, die seit mehr als fünf Jahren an Diabetes erkrankt waren, sogar noch mehr als bei neu diagnostizierten Patienten.
Dieser Befund deutet darauf hin, dass die Hsp70-Konzentration im Blutserum auf eine Stoffwechselstörung im Verlauf des Diabetes hinweist.
Krebs
Hitzeschockproteine haben das Potenzial, eine entscheidende Rolle bei der Identifizierung von Krebs zu spielen. Eine hohe Expression von extrazellulären Hitzeschockproteinen weist nachweislich auf hochaggressive Tumorzellen hin.
Außerdem korreliert es mit der Zellproliferation, dem Krebsstadium und schlechten klinischen Ergebnissen, was auf den potenziellen Nutzen der Hitzeschockprotein-Expression bei der Krebsdiagnose hinweist. Onkologen haben sogar begonnen, Hitzeschockproteine zur Diagnose von Mundkrebs einzusetzen.
Techniken wie Dot-Immunoassay und ELISA haben ihr Potenzial für die Krebsdiagnose bewiesen. Die Forscher haben festgestellt, dass HSP-spezifische Phagen-Antikörper bei der Krebsdiagnose im Reagenzglas (in vitro) von Nutzen sind.
Hitzeschockproteine stehen nachweislich auch in Wechselwirkung mit Krebsanpassungen wie Medikamentenresistenz, Tumorzellproduktion und Lebenserwartung. Die Hoch- und Herunterregulierung der mit Krebs assoziierten microRNA wird als Onkomiren bezeichnet.
Hsp90 ist einer der vielversprechendsten Kandidaten für die Diagnose, Prognose und Behandlung von Krebs, und für Hsp70, Hsp60 und kleine HSP wurde ein potenzieller Nutzen für die Behandlung nachgewiesen:
- Neurodegenerative Erkrankung
- Ischämie
- Zelltod
- Autoimmunität
- Transplantatabstoßung
- Andere kritische Krankheiten
Pharmazeutische Anwendungen
Krebs-Impfstoffe
Hitzeschockproteine wirken effizient als immunologische Adjuvantien, die die Immunantwort auf einen Impfstoff verstärken können.
Darüber hinaus deuten einige Studien darauf hin, dass Hitzeschockproteine bei der Bindung von Proteinfragmenten abgestorbener und bösartiger Zellen, wie z. B. Krebszellen, eine Rolle spielen könnten und sie dem Immunsystem zur Bekämpfung zur Verfügung stellen.
Es wurde auch festgestellt, dass Hitzeschockproteine die Signalwege beeinflussen, die an der Bildung von Krebszellen oder der Krebsentstehung beteiligt sind. Letztendlich können Hitzeschockproteine die Wirksamkeit von Impfstoffen gegen Krebs erhöhen. Isolierte Hitzeschockproteine aus Tumorzellen können als Anti-Tumor-Impfstoff dienen.
Da Tumorzellen unter ständigem Stress stehen und eine große Anzahl mutierter Onkogene oder krebsverursachender Gene chaperonisieren müssen, bilden sie eine außergewöhnliche Menge an Hitzeschockproteinen innerhalb der Tumorzellen.
Wenn sie aus dem Tumor isoliert werden, haben diese speziellen Hitzeschockproteine ein Peptidrepertoire, das als Landkarte oder Fingerabdruck der Tumorzellen dient, aus denen sie stammen.
Diese Hitzeschockproteine können dem Patienten zurückgegeben werden, um ihn bei der Bekämpfung des Tumors zu unterstützen, mit dem Ziel der Tumorrückbildung.
Anti-Krebs-Therapeutika
Hitzeschockproteine werden in Krebszellen intrazellulär stark exprimiert. Sie sind entscheidend für das Überleben von Krebszellen und fördern sogar invasivere Zellen oder die Metastasenbildung von Tumoren.
Aus diesem Grund haben niedermolekulare Inhibitoren von Hitzeschockproteinen wie Hsp90 das Potenzial, ein Krebsmedikament zu sein. Die Forscher untersuchen diese potenziellen Therapeutika. Die klinische Erprobung steht jedoch noch aus.
Autoimmunität Behandlung
Hitzeschockproteine können als schadensassoziierte molekulare Muster fungieren, d. h. als Moleküle in Zellen, die Teil der angeborenen Immunantwort sind und von Zellen freigesetzt werden, die aufgrund eines Traumas oder einer Infektion sterben. Daher können Hitzeschockproteine bestimmte Autoimmunkrankheiten extrazellulär fördern.
Es hat sich jedoch herausgestellt, dass Hitzeschockproteine bei Patienten mit Autoimmunkrankheiten eingesetzt werden können, um Immuntoleranz zu induzieren und die Behandlung dieser Krankheiten zu unterstützen.
Hsp90-Inhibitoren haben aufgrund ihrer Rolle bei der korrekten Faltung von entzündungsfördernden Proteinen auch das Potenzial zur Behandlung von Autoimmunerkrankungen. Krankheiten wie rheumatoide Arthritis und Typ-1-Diabetes können durch Autoimmunitätsbehandlungen behandelt werden.
Anwendungen zu Hause
Hitzeexposition
Bewusste Wärmeeinwirkung, insbesondere Saunabesuche, können eine positive Rolle bei der Erhaltung der Gesundheit spielen und haben Vorteile, die von der Herz-Kreislauf-Gesundheit bis zur Freisetzung von Wachstumshormonen reichen.
Saunieren 2-3x pro Woche, bis zu 7x pro Woche für 5-20 Minuten pro Sitzung bei etwa 80-100℃ (176-212℉) kann sich positiv auf die kardiovaskuläre Gesundheit auswirken, die Stimmung durch die Freisetzung von Dynorphinen und Endorphinen verbessern und die Stressreaktion verbessern.
Hitzeeinwirkung ist eine Form der Hormesis, eine milde, tolerierbare Belastung für den Körper, die zu einer positiven Anpassung führt.
Ein Saunabesuch kann den Cortisol- oder Stressspiegel senken und die Aktivierung der DNA-Reparatur- und Langlebigkeitspfade fördern, indem er die Hitzeschockproteine erhöht.
Der thermische Stress, der durch das Saunieren im Körper entsteht, führt zu einer Hochregulierung der intrazellulären Schwerschockproteine, wodurch die Proteinaggregation verhindert, der Transport von Reparaturproteinen unterstützt und das Immunsystem gestärkt wird.
Hitzestress hat enorme Vorteile für die allgemeine Gesundheit aller Menschen. Studien zeigen, dass eine rechtzeitige Wärmebelastung denjenigen, die aufgrund ihres Alters, einer Verletzung und/oder einer chronischen Krankheit nicht in der Lage sind, sich in dem empfohlenen Umfang zu bewegen, Vorteile bringen kann, die normalerweise bei sportlicher Betätigung zu finden sind.
Kälteexposition
Auch für Hitzeschockproteine ist eine bewusste Kälteexposition von Vorteil. Eine Studie über Kälteexposition ergab, dass kalte Temperaturen zu einer gewebeselektiven Einführung von Hitzeschockproteinen im braunen Fettgewebe führen, was erhebliche Vorteile für den Stoffwechsel hat.
Diese kälteinduzierte Expression von Hitzeschockproteinen hat den besonderen Vorteil, dass die Bindung ihrer Transkriptionsfaktoren an die DNA verstärkt wird.
Zum Mitnehmen
Zusammenfassend lässt sich sagen, dass die Welt der Hitzeschockproteine (HSPs) ein vielversprechender Weg ist, um neurodegenerative Krankheiten besser zu verstehen und zu bekämpfen.
Diese Stressproteine, deren Aufgabe es ist, denaturierte Proteine wieder zu falten und das zelluläre Gleichgewicht aufrechtzuerhalten, könnten einen Durchbruch bei der Entwicklung von Therapien bedeuten.
In dem Maße, wie wir das komplizierte biologische Geflecht entschlüsseln, könnte der gezielte Einsatz von Hitzeschockproteinen der Schlüssel zur Bewältigung der Komplexität neurodegenerativer Erkrankungen sein und Hoffnung auf bessere Behandlungen und eine bessere Zukunft geben.
Referenzen
Bakterielle Sigma-Faktoren und Anti-Sigma-Faktoren: Struktur, Funktion und Verteilung - PMC.
Protokolle zur gezielten Wärmeexposition für Gesundheit und Leistung - Huberman Lab
Extrazelluläre Hitzeschockproteine und Krebs: Neue Perspektiven - PMC
Hitzeschockprotein - ein Überblick | ScienceDirect Topics
Hitzeschockproteine: Anstandsdamen für die DNA-Reparatur | Oncogene.
Hitzeschockproteine: ein erwägenswertes therapeutisches Ziel - PMC.
Hitzeschockproteine: Ein Überblick über die molekularen Chaperone - ScienceDirect
Hitzeschockprotein - Wikipedia
Erhöhte HSP70-Werte im Serum stehen in Zusammenhang mit der Dauer des Diabetes - PMC
Stress (Hitzeschock)-Proteine | Kreislaufforschung
Transkription (Biologie) - Wikipedia
Haftungsausschluss
Der Inhalt dieses Artikels dient nur zu Informationszwecken und soll nicht als Ersatz für professionelle medizinische Beratung, Diagnose oder Behandlung dienen. Es wird immer empfohlen, einen qualifizierten Gesundheitsdienstleister zu konsultieren, bevor Sie gesundheitsbezogene Veränderungen vornehmen oder wenn Sie Fragen oder Bedenken zu Ihrer Gesundheit haben. Anahana haftet nicht für Fehler, Auslassungen oder Folgen, die sich aus der Verwendung der bereitgestellten Informationen ergeben können.

By: Clint Johnson
Clint ist die treibende Kraft und der Gründer von Anahana. Clint unterrichtet Yoga, Pilates, achtsames Atmen und Meditation und wendet sich an eine globale Gemeinschaft von Schülern und Lehrern.
